מה שעשוי להיות אחת המהפכות שתשנה את פני הרפואה, לפחות ברמת הפוטנציאל, התחיל לפני כמעט 30 שנה בפטוניות סגולות. כמה חוקרים מתחום הבוטניקה החליטו להפוך אותן לעוד יותר סגולות. הם מצאו מה הגן שאחראי לצבע שלהן, הוסיפו אותו לפטוניות, אבל במקום התוצאה המקווה, הפרחים הפכו דווקא לבנים. כך התגלתה תופעה שלימים תיקרא "השתקת גנים".
עשרות שנים חלפו, מיליארדי דולרים נשפכו, חברות הוקמו ונסגרו, ורק בספטמבר 2018 הגילוי הזה היתרגם לתרופה הראשונה אי פעם להשתקת גנים שקיבלה את אישור מינהל התרופות והמזון האמריקאי: אונופטרו (Onpattro) המטפלת במחלה גנטית וחשוכת מרפא בשם עמילואידוזיס משפחתית. מדובר במחלה הפוגעת בקבוצות אתניות שונות שאין ביניהן קשר ברחבי העולם, שיכולה להגיע ללב ולמערכת העצבים ולהפוך אדם בריא לשבר כלי תוך זמן לא רב. אצלנו בישראל, אחת המוטציות שלה מופיעה אצל כמה משפחות של יוצאי תימן.
מי שעומדים מאחורי התרופה הזו הם חברת אלנילם (Alnylam), והנשיא שלה זה 16 שנים עקלקלות, בארי גרין - האיש שהמשיך להאמין בטכנולוגיה לאורך כל הדרך. "דיברתי עם מישהו שהיה חלק מהניסוי שלנו", הוא מספר בראיון ל-G. "כשהוא התחיל להרגיש את התסמינים, לפני חמש או שש שנים, הוא פנה לכמה וכמה רופאים. בהתחלה הוא קיבל אבחון לא נכון. עברו שלוש שנים וחצי עד שהגיעו לאבחון הנכון, ואז לא הייתה תרופה. אחר כך הוא חיכה שיתחיל הניסוי, ועד שזה קרה, מצבו הידרדר עד כדי כך שהלך עם קביים ולא הצליח להשתמש היטב בידיים. עכשיו הוא מסיע את הנכדה שלו לבית הספר וחזרה".
אבל המהפכה הפוטנציאלית שמסתתרת מאחורי סיפור מרגש כמו זה היא כמובן גדולה לאין שיעור. התקווה היא שההצלחה הנקודתית בעמילואידוזיס תוכל להיתרגם למהפכה שתמצא מזור להרבה מחלות גנטיות קשות וחשוכות מרפא, באותה דרך של השתקת גנים.
רק שגם אחרי ההצלחה האחרונה, בין החזון למציאות עדיין עומדת המציאות היומיומית שבינתיים, גם גרין מודה, היא הרבה יותר אפורה. "אנחנו עדיין רחוקים שנים רבות מכך שהעולם יקבל אותנו כקטגוריה שהולכת להוביל מהפכה", הוא אומר. "אבל נלחמנו לטפס למעלה בכל שלב מחיי החברה, ואנחנו מקבלים את האתגר. הקהילה הרפואית מתלהבת, אני חושב שכולם הבינו שיש כאן פוטנציאל למהפכה. אבל אנחנו כמובן צריכים להראות את זה תרופה אחר תרופה".
שווי השוק של אלנילם שנסחרת בנאסד"ק - כמעט 8 מיליארד דולר - משקף זה כמה שנים את ההתקדמות ואולי גם מעט מן הפוטנציאל של חלק מן המוצרים בצנרת, אבל הוא כמובן עדיין רחוק מלשקף את תקוות המהפכה שגרין משוכנע שתגיע.
"וול סטריט מנסה להעריך עסק, להבין מתי נהיה רווחיים", הוא מתייחס לכך. "תמיד יש סקפטיות סביב השאלה כמה כסף צריך להשקיע בחברה עד שתהפוך לרווחית. אנחנו מאמינים שאם נפתח מוצרים טובים זה יבוא, אבל אנחנו רוצים להמשיך להשקיע. בסופו של דבר נגיע לרווחיות, אין ברירה. אבל עכשיו אנחנו עסוקים בפיתוח תרופות והחדרתן באופן גלובלי, וזה מצריך השקעה משמעותית".
"תמיד ידענו שנגיע"
הפטוניות היו רק ההתחלה. בעקבותיהן, שני חוקרים בשם פייר ומלון בדקו איך עושים זאת בתולעים והצליחו, ב-1998, לבטל התבטאות של גנים גם אצלן. הם נתנו לסוג הפעולה הזה את הכינוי "התערבות RNA". RNA היא המולקולה ה"מתרגמת" או "משעתקת" את המידע הגנטי לחלבון, והיכולת להשתיק גנים עוברת דרכה. כלומר, הרעיון הוא לא להתערב בגנום אלא למנוע מגנים מסוימים לבוא לידי ביטוי בחלבונים ובכך למנוע את ההשפעה שלהם. להרוג את השליח, אם תרצו. "זה מנגנון כל-כך פשוט", אומר גרין, "שאנשים לא הבינו איך פספסו את זה".
ארבע שנים מאוחר יותר, ב-2002, יצאה אלנילם לדרך. המייסדים המדעיים שלה היו זוכה פרס נובל, טום טושל, ומדענים נוספים. טושל הצליח להראות שהמנגנון הזה עובד גם ביונקים ופרסם זאת ב-2001 בכתב העת המדעי היוקרתי "נייצ'ר", מה שהזניק את התחום לכותרות. גרין עצמו הצטרף שנה מאוחר יותר.
"התחלנו את אלנילם כסטארט-אפ בקיימברידג', מסצ'וסטס", הוא משחזר, "עם הרבה התלהבות. אבל לא היו ימים קלים, כי יצאנו לציבור ב-2004, בתקופה שבה ביוטכנולוגיה לא הייתה השקעה מועדפת. תמיד חיינו במנטליות של אתגר, אבל תמיד האמנו במדע שלנו ובפוטנציאל של התערבות RNA לטפל במחלות רבות. חווינו ונמשיך לחוות עליות ומורדות, אבל אנחנו נחושים ועקשנים".
גרין, מהנדס כימי ותעשייתי בהכשרתו, גדל בברוקלין שבניו יורק במשפחה יהודית ומפטפט לא רע בעברית ("אשתי היא בחורת ישיבה", הוא מצהיר). את הקריירה החל בפירמת ראיית החשבון והייעוץ אנדרסון (שכבר איננה קיימת) כיועץ שניהל את עסקי מדעי החיים של הפירמה ("תמיד אהבתי מדע ורפואה"). אחד הלקוחות שלו מאותה תקופה הפך למנכ"ל חברת התרופות אסטרה זנקה וביקש ממנו להצטרף לחברה כמנהל הפעילות המסחרית. לאחר מכן עבר לחברת מילניום וניהל בה את תחום האונקולוגיה. שם פגש את ג'וליאן אדמס, היום יו"ר גמידה סל, ויחד עבדו על וולקייד, אחת מתרופות המפתח לסרטן מסוג מיילומה נפוצה. מאז, "רוב חיי כמעט", הוא באלנילם.
כמו שאמרת, היו שנים לא קלות בחברה. בשום שלב לא שקלת לעזוב?
"לא, לא חשבתי לעזוב, והחברה לא חשבה לעבוד על משהו אחר. תמיד ידענו שנגיע".
ובכל זאת, החברה נוסדה ב־2002 והתרופה הראשונה יצאה רק עכשיו. מה לקח לכם כל־כך הרבה זמן?
"מה שלקח כל-כך הרבה זמן היה למצוא איך להביא את המולקולה הרלוונטית (SiRNA) למקום שבו תוכל לפעול, לציטופלזמה של התא. מ-2002 ועד 2010 השקענו הרבה כסף ואנרגיה במערכת ההולכה".
היה זמן שחשבו שהתחום גווע ונעלם.
"ב-2010 העולם לא האמין שזה יגיע. חברות פארמה יצאו מהתחום. רוב החברות האמינו שזה ייקח עוד 20 שנה. אנשים הרגישו שהפיתוח איטי וגל ההתלהבות נגמר. אבל אנחנו חשבנו שזה מתקדם. אנחנו אמרנו כבר אז שעד 2015 יהיו לנו חמש תרופות בשלבי ניסוי קליניים, ובפועל היו לנו שמונה. שנה לאחר מכן הודענו שעד 2020 אנחנו צופים שיהיו לנו שלוש תרופות (מאושרות לשימוש) בשוק, והיום אני חושב שאולי יהיו לנו יותר".
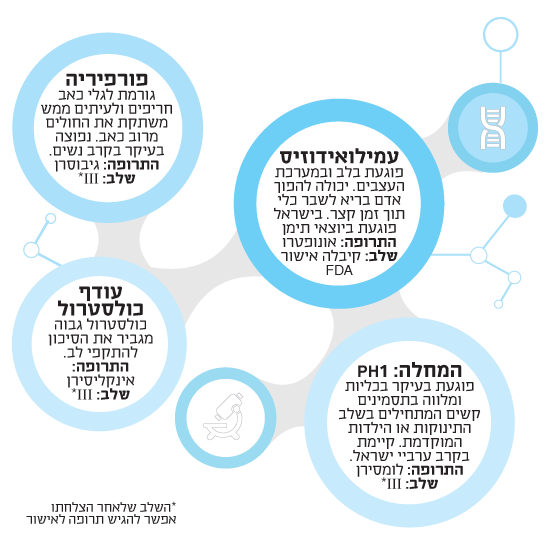
אחת מאותן תרופות בפיתוח עוסקת במחלה גנטית נדירה, PH1 שמה, שפוגעת בתינוקות ובילדים באוכלוסייה הערבית-ישראלית. מדובר במחלה הפוגעת בעיקר בכליות, המלווה בתסמינים קשים המתחילים בגיל מאוד מוקדם - בשלב התינוקות או הילדות המוקדמת. "ישראל מעורבת בניסוי הקליני של התרופה, ואנחנו עובדים עם חמישה-שישה מרכזי בריאות בישראל", אומר גרין. אם הניסוי יצליח, הוא ישנה את חייהם של כמה עשרות ילדים ומשפחותיהם.
תרופה נוספת בקנה של החברה - הנמצאת כרגע בניסוי בשלב III (השלב האחרון שלאחר הצלחתו אפשר להגיש תרופה לאישור) היא גיבוסרן, לטיפול במחלה הגנטית פורפיריה, הנפוצה יותר בקרב נשים וגורמת לגלי כאב כל-כך חריפים, שגם משככי הכאבים החזקים ביותר לא תמיד עוזרים להן, ולפעמים ממש משתקת את החולות מרוב כאב. "אנשים אומרים לנשים האלה: ‘אין לך כלום, את היפוכונדרית, את רוצה סמים'. נוציא לך את השחלות ונראה מה יקרה. הן מגיעות אלינו (לניסוי) חתוכות לגמרי".
אבל האמת היא שאלנילם שואפת לחרוג מתחום המחלות הגנטיות ולעבור לתרופות המיועדות לחלקים נרחבים של האוכלוסייה. קחו למשל נושא שמציק לחלק גדול מהאוכלוסייה כמו עודף כולסטרול. האם אפשר לטפל במחלה הכה נפוצה הזאת בכלים של התערבות ב-RNA? תרופה בשם אינקליסירן (Inclisiran) שעליה עובדים בחברה מבוססת על גילוי מהתקופה האחרונה של חלבון מסוים (PCSK9) שהתברר שכאשר רמתו נמוכה, הסיכוי ללקות בהתקפי לב יורד דרמטית - עד 88%.
הרעיון בתרופה, שמפותחת בשיתוף עם חברת The Medicines, מבוסס על אותו עיקרון של שאר התרופות של החברה, "השתקת" RNA, כדי שהגנים לא יוכלו לשלוח לגוף מסר לקודד את החלבון שאחראי להרס הקולטן של ה"כולסטרול הרע" (LDL) - הרס שמוביל לכך שהגוף לא יכול לסלק את ה-LDL החוצה, מה שמגביר את הסיכון לכולסטרול גבוה שמוביל להתקפי לב.
זו כמובן אינה התרופה היחידה שקשורה לתחום ומבוססת על נטרול החלבון המרושע הזה, אך היא כן היחידה שמטפלת בכך דרך ה-RNA, ולא תוקפת ישירות את החלבון. "היו כמה נוגדנים לאותו חלבון", אומר גרין, "אבל המוצר שלנו מאוד בטוח, ובינתיים נראה שהוא מביא לירידה משמעותית בכמות ה-LDL. זו תרופה שכנראה אפשר יהיה לקחת אותה רק פעמיים בשנה (בהזרקה תת עורית)".
נחמד, אבל מה עם תופעות הלוואי?
"בעיקרון, פרופיל הבטיחות לא רע. לכל תרופה יש השפעות שונות וייחודיות, ויש שיקולים של עלות-תועלת. אם 50% מהמטופלים סובלים מבעיות באתר ההזרקה, זה טוב במחלה קטלנית ונדירה, אבל לא בטיפול בעודף כולסטרול. שם צריכים להיות הרבה יותר נקיים מתופעות לוואי, ואנחנו הופכים יותר חכמים עם השנים ויוצרים בהדרגה מולקולות שקטות יותר".
שיתוף פעולה נוסף שיש לאלנילם, בשווי מיליארד דולר, הוא עם חברת ריג'נרון, לפיתוח תרופות בתחום מערכת העצבים המרכזית והעיניים. 800 מיליון דולר מתוך הסכום - 400 מיליון דולר במזומן ועוד 400 מיליון במניות - כבר הושקעו, ויש עוד שתי אבני דרך שבכפוף להן תעביר החברה עוד 100 מיליון דולר בכל פעם, במהלך השנה הקרובה.
בחברה עובדים גם על תרופה להפטיטיס B (צהבת) שמאות מיליוני אנשים בעולם חולים בה. אומנם מדובר במחלה מדבקת שאיננה תלויה במבנה החלבון של מי שנדבק בה, אבל העיקרון בתרופה הזאת - שמפותחת בשיתוף פעולה עם חברה בשם VIR - יהיה לתקוף את החלבון שיוצר את הווירוס.
שיתוף פעולה אחר, עם חברת סנופי, לפיתוח כמה תרופות להמופיליה ולמחלות נוספות, דווקא הגיע אל סוף דרכו באחרונה בשל שינויים פנימיים בסנופי וחילופי מנכ"ל שם. "שיתוף הפעולה הסתיים, אבל אנחנו עדיין הורים משותפים של כמה מולקולות", אומר על כך גרין.
המחלות שאלנילם רוצה לנצח
"נסרב להצעת רכישה"
ובחזרה לתרופת האונופטרו פורצת הדרך שקיבלה לאחרונה את האישור. כרגע מטופלים בה באופן מסחרי 400 חולים, ובאופן לא מסחרי כל החולים שהשתתפו בניסוי. בכל העולם ידועים 50 אלף חולים במחלת העמילודוזיס התורשתית, אבל למחלה הזאת יש גם גרסה שאיננה תורשתית, ואלנילם נושאת עיניה גם לחולים האלה, כ-300-200 אלף חולים ברחבי העולם. "וזה עוד מספר שהוא אולי הערכת חסר", אומר גרין, "ייתכן שמדובר פה בהזדמנות כמו זו שהייתה גלומה בטרשת נפוצה לפני 30 שנה - להגיע לשוק של כמה מיליארדי דולרים (רומז לתחום שהזניק קדימה את טבע הודות לתרופת הקופקסון שפיתחה). אנחנו עושים עכשיו ניסוי קליני לטפל בחולים שמקור מחלתם אינו תורשתי".
אבל גם לענקית התרופות פייזר יש תרופה לטיפול בעמילודוזיס - משני הסוגים - שקיבלה אישור באירופה וגם בארצות הברית, וזו חברה גדולה וחזקה מכם.
"זה טוב שיש עוד חברות, כי העיקר עכשיו הוא חינוך השוק ויצירת מודעות למחלה. החולה שסיפרתי עליו קודם קיבל בהתחלה אבחונים שגויים כי אף אחד לא חשב בכלל על המחלה הזאת. הרופאים שלו לא העלו זאת על דעתם. העניין הוא לא מי יקבל איזה חלק מהעוגה, אלא להגדיל את העוגה".
מה ההבדל בין התרופה שלכם לשלהם?
"הם מונעים מהחלבון להתקפל (אם החלבון לא מקופל, הוא לא יכול לפעול ולא יכול לחולל את המחלה), אנחנו מונעים ממנו להיווצר מלכתחילה".
ומה יותר יעיל?
"עשינו ניסויים מאוד שונים. אנחנו רואים שאצל רוב החולים המחלה נעצרת ובמקרים רבים גם רואים תיקון של הנזק הנוירולוגי. הם רק הראו שיפור בשיעורי האשפוז ושיפור בשרידות. אז אנחנו מאמינים שיש לנו את התרופה הטובה יותר, אבל אנחנו צריכים להשלים את הניסויים הקליניים כדי להוכיח שהיא טובה לשני סוגי המחלה (גם לסוג שאינו תורשתי)".
איך אתם מתמחרים את התרופות? הרי כדי לכסות עלות פיתוח של "תרופות יתום" - תרופות המיועדות למחלות נדירות ולכן למספר לא גדול של חולים - צריך לתמחר אותן בסכום ניכר.
"עשינו בכל העולם הסכמים מבוססי ערך. כלומר, אנחנו אלה שנושאים בסיכון הקשור למידת היעילות של התרופה. התוצאה היא שחברות הביטוח מוכנות לקבל את התרופה לסלי התרופות שלהן. בארצות הברית, לדוגמה, המוצר מכוסה עבור 90% מהמטופלים. זה מאוד משמעותי עבור ‘תרופת יתום'".
תסביר איך ההסכם הזה עובד.
"הרעיון הוא שככל שהתרופה יעילה יותר, מגיע לנו יותר. הרי עבדנו שנים רבות והשקענו משאבים רבים בפיתוח. בעמילואידוזיס, למשל, אם הצלחנו להפחית נכות של חולה, התשלום גבוה יותר מאשר אם לא הצלחנו. אין במודל הזה מצב שלא משלמים לנו בכלל, כי יש חוק בארצות הברית שקובע מחיר מינימום לתרופה. חברות הביטוח אוהבות את הגישה הזאת".
בישראל, חברת מדיסון פארמה היא המשווקת עבור אלנילם, והיא תצטרך כמובן לנסות להכניס אותה לסל התרופות כאן. "במחלות נדירות, הנטל על התקציב הוא קטן גם אם התרופה יקרה", טוען גרין. "בישראל, לדוגמה, יהיו חולים בודדים שיזדקקו לה. קובעי תקציבי תרופות יותר מודאגים ממחיר תרופות המיועדות לקהלים רחבים יותר, כמו סוכרת וכולסטרול".
אז כמה יעלה המוצר שלכם לטיפול בכולסטרול?
"אם יהיה לנו מוצר לכולסטרול, נצטרך למכור אותו ב-4,000 עד 6,000 דולר לשנה".
מה תגידו להצעת רכישה?
"אנחנו חושבים שהעצמאות שלנו קריטית. אנחנו בידיים של יזמים נחושים ורעבים שעברו את האתגרים וזה מה שצריך. נסרב להצעת רכישה".
כלומר, אתה סבור שאם תהיו בבעלות חברת פארמה גדולה, ההתלהבות והנחישות שלכם ירדו?
"כן. הניסיון מראה שחברות גדולות הן לא המקום הטוב ביותר לחדשנות. מובן שאם וכאשר יש הצעה ספציפית, חייבים להביא אותה לפני הדירקטוריון, אבל אנחנו רוצים להיות עצמאיים למשך שנים רבות קדימה".
המהפכה שעדיין לא קיימה | למה הפוטנציאל של תרופות המבוססות על "התערבות RNA" הוא כמעט אינסופי
כדי להבין מדוע תרופות שמתבססות על RNAi מהוות מהפכה, יש להבין מהו המנגנון שבאמצעותו הגנטיקה שלנו באה לידי ביטוי בגוף, וכיצד פועלות התרופות של ימינו. באנלוגיה לא מושלמת ניתן לומר שאם הגנום שלנו הוא קובץ מחשב שעל בסיסו יודפס ספר, ובספר הזה עלולות ליפול טעות, הרי שהתרופות הקיימות הן כמו ניסיון למצוא כל עותק של הספר שיצא לעולם כדי לתקן בו את הטעות. תרופות מסוג RNAi, לעומת זאת, הן מעין ניסיון לתפוס את המידע לאחר שיצא מהמחשב אך לפני שעבר להדפסה ולתקן אותו בשלב הזה (ותרפיה גנטית, שאולי תגיע בעתיד, תהיה ניסיון לשנות את קובץ המקור עצמו).
ובחזרה לגוף האדם: הגנים שלנו נמצאים בגרעין התא ובאים לידי ביטוי בגוף על-ידי כך שקודם כול נוצרת להם תמונת מראה מחומר בשם RNA. ה-RNA הוא רצף ארוך ודק שמקודד חלבון ארוך ודק במקביל אליו, אבל אחר כך החלבון מתקפל לצורה מסוימת והופך להיות בעל מבנה תלת ממדי מסובך.
תרופות קלאסיות פועלות בדרך של פגיעה באחד החלבונים, אבל לשם כך יש להבין לעומק את המבנה התלת ממדי המורכב של החלבון ולמפות במדויק את המפגשים בין המפתח למנעול. וזה בכלל לא פשוט.
לעומת זאת, התערבות בשלב ה-RNA פירושה שהחלבון לעולם לא ייווצר, כך שאין צורך לרוץ לתפוס אותו בכל מקום בתוך הגוף. כפועל יוצא מכך, תרופה כזו גם אמורה להיות אפקטיבית במינון הרבה יותר נמוך. מה עוד שהשתקת RNA אמורה להיות תהליך טכני יותר קל מאשר הפיתוחים המורכבים שתיארנו קודם שנועדו להילחם בחלבון.
יתרה מכך, תיאורטית ניתן לפתח תרופת השתקת RNA יחסית בקלות לכל מחלה שמקורה בפגם שנובע מפעילות לא תקינה של גן, כך שתרופות כאלה יכולות להיות רלוונטיות לדיכוי התהליך הסרטני, למחלות נירולוגיות שונות ואפילו לטיפול במחלות זיהומיות (על-ידי דיכוי פעילות ה-RNA של הווירוס או החיידק עצמו). זאת, בנוסף כמובן למחלות גנטיות.
מנגד, צריך לזכור שבדרך בפני כל הדברים הנפלאים הללו עוד עומדים לא מעט מכשולים. צריך למצוא דרך להוליך את התרופה כך שתפעל במקום הנכון, ולוודא שלתהליך ה"התערבות" לא יהיו תופעות לוואי, משום שהחלבון שאת היווצרותו מונעים עשוי להיות דרוש לפעולות אחרות בגוף.
גלי וינרב